Produs retras Forma farmaceutica Concentratie DCI Producator/DAPP Serie Motivul retragerii Actiune propusa Data retragerii
|
|
|
- Nichifor Nistor
- 2 ani în urmă
- Vzualizari:
Transcriere
1 Produs retras Forma farmaceutica Concentratie DCI Producator/DAPP Serie Motivul retragerii Actiune propusa Data retragerii capsule moi 250 mg nitroxolin Chephasar Chem.- Pharm.Fabrik GmbH, Germania/Mip Pharma GmbH, Germania , retragere voluntara de pe ca masura de precautie, urmare a scaderii unei valori limita pentru calificarea substantei active Retragere voluntara si Nitroxolina-MIP 250 mg Ranitidina 150 mg comprimate 150 mg ranitidina Magistra C&C SRL, Romania toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Ranitidin 150 mg comprimate filmate 150 mg ranitidina Arena Group SA toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Ranitidin Arena 150 mg comprimate filmate 150 mg ranitidina Arena Group SA toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Ranitidina Arena 75 mg capsule 75 mg ranitidina Arena Group SA toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Ranitidina Arena 300 mg capsule 300 mg ranitidina Arena Group SA toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / )
2 Ranitidina Helcor 150 mg comprimate filmate 150 mg ranitidina AC Helcor Pharma SRL toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Ranitidina Helcor 75 mg comprimate filmate 75 mg ranitidina AC Helcor Pharma SRL toate seriile retragere la nivel de farmacie a tuturor seriilor, ca urmare a suspendarii tuturor APP valide pentru medicamentele care contin ranitidina (conform deciziei Comisiei Europene C / ) Cefotax 1 g pulbere + solvent pentru solutie injectabila im/iv 1 g cefotaxim Felsin Farm SRL Romania/EIPICO Med SRL, Romania retragere voluntara de pe, ca urmare a identificarii unei neconformitati legata de data de expirare inscriptionata pe solventul a 3416 ct din totalul de ct (inscriptionat /real ) Retragere voluntara si Zerbaxa R 1 g /0,5 g pulbere pentru concentrat pentru solutie injectabila 1 g /0,5 g combinatii (ceftolozan+ tazobactam) Arvato Distribution GmbH, Germania/ Merck Sharp&Dohme B.V. Olanda T retragere voluntara la nivel de farmacie/spital, ca masura de precautie, urmare a efectuarii testelor de sterilitate de rutina pentru alte serii (nedistribuite pe din Romania) care au identificat o contaminare bacteriana Retragere voluntara si Nitrofurantoina Arena 100 mg comprimate 100 mg nitrofurantoina Arena Group SA, Romania retragere ca urmare a obtinerii unui rezultat in afara specificatiei pentru parametrul "Dizolvare g%", urmare a testarii la parametrii relevanti in cadrul Planului anual de prelevare si testare pe anul Entecavir Zentiva K.s. 0,5 mg comprimate filmate 0,5 mg entecavir Zentiva SA, Romania/Zentiva K.S. Rep. Ceha toate seriile retragere voluntara de pe, ca urmare a eliminarii medicamentului din CaNaMed si din Catalogul Public incepand cu data de Retragere voluntara si Entecavir Zentiva K.s. 1 mg comprimate filmate 1 mg entecavir Zentiva SA, Romania/Zentiva K.S. Rep. Ceha toate seriile retragere voluntara de pe, ca urmare a eliminarii medicamentului din CaNaMed si din Catalogul Public incepand cu data de Retragere voluntara si
3 Bortezomib Zentiva 3,5 mg pulbere pentru solutie injectabila 3,5 mg bortezomib Synthon Hispania SL, Spania/Zentiva K.S. Cehia toate seriile retragere voluntara de pe, ca urmare a eliminarii medicamentului din CaNaMed si din Catalogul Public incepand cu data de Retragere voluntara si Tenofovir Disoproxil Zentiva 245 mg comprimate filmate 245 mg tenofovir disproxil Zentiva SA, Romania/Zentiva K.S. Rep. Ceha toate seriile retragere voluntara de pe, ca urmare a eliminarii medicamentului din CaNaMed si din Catalogul Public incepand cu data de Retragere voluntara si Irinotecan Accord 20 mg/ml concentrat pentru solutie perfuzabila 20 mg/ml irinotecan Accord Healthcare Polska SP. Z.O.O., Polonia X21211 retragere urmare a unei neconformitati de calitate Binocrit UI/0,75 ml solutie injectabila in seringa preumpluta UI/0,75 ml epoetina alfa Hexal Biotech Forschungs GmbH-Germania/Sandoz GmbH-Austria retragere voluntara de pe la nivel de farmacie, urmare a obtinerii unor rezultate in afara specificatiei aprobate pentru parametrul "Met(54)Ox" (urmare a extinderii investigatiilor efectuate de producator) Binocrit UI/1 ml solutie injectabila in seringa preumpluta UI/1 ml epoetina alfa Hexal Biotech Forschungs GmbH-Germania/Sandoz GmbH-Austria , , retragere voluntara de pe la nivel de farmacie, urmare a obtinerii unor rezultate in afara specificatiei aprobate pentru parametrul "Met(54)Ox" (urmare a extinderii investigatiilor efectuate de producator) Analgex 400 mg/325 mg comprimate filmate 400 mg/ 325 mg combinatii (ibuprofen+ paracetamol) Laropharm SRL M02241 retragere voluntara la nivel de farmacie, urmare a identificarii unei erori de inscriptionare a ambalajului secundar Orfiril Long 1000 mg cutie x 50 mini-plicuri cu mini-comprimate cu eliberare prelungita 1000 mg valproat de sodiu Desitin Arzneimittel GmbH, Germania retragere voluntara la nivel de distribuitor, urmare a obtinerii unui rezultat in afara specificatiei pentru paramentrul "Dozare substanta activa" Depakine 57,64 mg/ml sirop 57,64 mg/ml valproat de sodiu Unither Liquid Manufacturing Franta/ Sanofi Romania SRL 592, 595 retragere voluntara de pe la nivel de farmacie, ca masura de precautie, urmare a inregistrarii unei reclamatii de calitate in Polonia
4 Binocrit UI/0,75 ml solutie injectabila in seringa preumpluta UI/0,75 ml epoetina alfa Hexal Biotech Forschungs GmbH-Germania/Sandoz GmbH-Austria retragere voluntara de pe la nivel de farmacie, urmare a obtinerii unor rezultate in afara specificatiei aprobate pentru parametrul "Met(54)Ox" Ranitidina LPH 150 mg comprimate filmate 150 mg ranitidina Labormed Pharma SA toate seriile retragere voluntara de pe la nivel de farmacie, ca masura de precautie, a tuturor seriilor blocate la vanzare urmare a identificarii impuritatilor nitrozaminice Ranitidina Laropharm 150 mg comprimate filmate 150 mg ranitidina Laropharm SRL toate seriile retragere voluntara de pe la nivel de farmacie, ca masura de precautie, a tuturor seriilor blocate la vanzare urmare a identificarii impuritatilor nitrozaminice Ranitidina ATB 150 mg comprimate filmate 150 mg ranitidina Antibiotice SA toate seriile retragere voluntara de pe la nivel de farmacie, ca masura de precautie, a tuturor seriilor blocate la vanzare urmare a identificarii impuritatilor nitrozaminice Emsya 5 mg comprimate 5 mg ulipristal acetat Gedeon Richter Plc. toate seriile retragere voluntara de pe (depozite si farmacii), ca urmare a initierii de catre PRAC-EMA a procedurii EMEA/H/A-31/1496 referitoare la revizuirea riscului in cazul medicamentelor care contin ulipristal acetat 5 mg, utilizate in tratarea fibroamelor uterine Sevorane 250 ml lichid volatil pentru inhalat sevofluran Aesica Queenborough Ltd. Marea Britanie/ Abbvie Deutschland GmbH, Germania toate seriile retragere voluntara de pe (depozite si farmacii), ca urmare a eliminarii medicamentului din CaNaMed si din Catalogul Public incepand cu data de
5 Indapamid LPH 2,5 mg comprimate filmate 2,5 mg indapamid Labormed Phama SA, Romania toate seriile aflate in termen de valabilitate (480483, , , , , ) retragere voluntara de pe (depozite si farmacii), ca urmare a obtinerii unor rezultate in afara specificatiei pentru parametrul "Dizolvare" pentru seria Arnetin 50 mg/2 ml solutie injectabila 50 mg/2 ml ranitidina Medochemie LTD, Cipru A711AH retragere voluntara de pe la nivel de farmacie, ca masura de precautie, urmare a identificarii unei tendinte crescatoare a nivelului impuritatilor nitrozaminice, in timpul testarilor efectuate KEPPRA 100 mg/ml conc. pt. sol. perfuz. 100 mg/ml levetiracetam UCB Pharma SA, Belgia toate seriile DEBRIDAT 24 mg/5ml DEBRIDAT 24 mg/5ml granule pentru suspensie orala granule pentru suspensie orala 24 mg/5ml x 125 ml trimebutina 24 mg/5ml x 250 ml trimebutina NUTRIFLEX OMEGA SPECIAL emulsie perfuzabila combinatii NUTRIFLEX OMEGA PLUS emulsie perfuzabila combinatii Farmea, Franta/Pfizer Europe MA EEIG, Belgia Farmea, Franta/Pfizer Europe MA EEIG, Belgia B.Braun Melsungen AG, Germania B.Braun Melsungen AG, Germania 3830, 3847, 3855, 3862, , 3805, 3806, 3807, 3808, 3809, 3810, 3811, 3812, 3813, 3835, 3836, 3837, 3838, 3839, 3840, 3841, 3842, 3843, 3849, 3850, 3864, 3865, 3868, 3869, 3870, 3871, 3872, , , , , , , , retragere voluntara de pe, ca urmare a eliminarii medicamentului din CaNaMed si Catalogul Public incepand cu data de retragere de pe, la nivel de farmacie, ca urmare a unui incident aparut pe linia de umplere a locului de fabricatie (cu posibilitatea foarte redusa ca un corp strain sa fi patruns intr-un flacon din cele 92 serii destinate retragere de pe, la nivel de farmacie, ca urmare a unui incident aparut pe linia de umplere a locului de fabricatie (cu posibilitatea foarte redusa ca un corp strain sa fi patruns intr-un flacon din cele 92 serii destinate retragere de pe, ca urmare a primirii unei alerte rapide din partea autoritatii competente din Franta, referitoare la aparitia unor neconformitati de calitate (cazuri rare de schimbare a culorii, retragere de pe, ca urmare a primirii unei alerte rapide din partea autoritatii competente din Franta, referitoare la aparitia unor neconformitati de calitate (cazuri rare de schimbare a culorii, Retragere voluntara si
6 AVONEX 30µg/0,5 ml PEN solutie injectabila in stilou injector (PEN) preumplut 30µg/0,5 ml Interferon Beta 1A FUCIDIN 20 mg/g crema 20 mg/g acid fusidic Biogen Manufacturing APS, Danemarca/ Biogen Netherland BV Olanda Leo Laboratories Ltd, Irlanda/Leo Pharma A/S, Danemarca , , retragere voluntara de pe la nivel de farmacie/spital, ca urmare a obtinerii unei valori in afara specificatiei, in cadrul testarilor periodice, precum si a emiterii unei alerte rapide de Retragere voluntara si retragere de pe, ca urmare a schimbarii clasificarii la eliberare (din medicamente care se elibereaza pe baza de prescriptie medicala, in medicamente care nu se elibereaza pe baza de prescriptie medicala-otc), FUCIDIN 20 mg/g unguent 20 mg/g acid fusidic Leo Laboratories Ltd, Irlanda/Leo Pharma A/S, Danemarca retragere de pe, ca urmare a schimbarii clasificarii la eliberare (din medicamente care se elibereaza pe baza de prescriptie medicala, in medicamente care nu se elibereaza pe baza de prescriptie medicala-otc), respectiv retragerea din CaNaMed si Catalogul Public (CIM:W ) incepand cu REMUREL 40 mg/ml solutie injectabila in seringa preumpluta 40 mg/ml glatiramer acetat Synthon BV, Olanda/ Alvogen IPCo, Luxemburg E retragere de pe, ca urmare a primirii unei alerte rapide din partea autoritatii din Polonia, ca urmare a identificarii unei neconformitati (prezenta de particule in suspensie peste limitele acceptate) GYNOZOL 200 capsule vaginale 200 mg miconazol Pharco Impex 93 SRL retragere de pe, din cauza nedepunerii la Ministerul Sanatatii a documentatiei necesare includerii medicamentului in CANAMED ed GYNOZOL 400 capsule vaginale 400 mg miconazol Pharco Impex 93 SRL retragere de pe, din cauza nedepunerii la Ministerul Sanatatii a documentatiei necesare includerii medicamentului in CANAMED ed
7 VITAMINA E 400 mg capsule moi 400mg tocoferol Pharco Impex 93 SRL retragere de pe, din cauza nedepunerii la Ministerul Sanatatii a documentatiei necesare includerii medicamentului in CANAMED ed VITAMINA A UI capsule moi UI retinol Pharco Impex 93 SRL retragere de pe, din cauza nedepunerii la Ministerul Sanatatii a documentatiei necesare includerii medicamentului in CANAMED ed NIFEDIPIN RETARD TERAPIA20 mg comprimate cu eliberare prelungita 20 mg nifedipin Terapia SA retragere de pe, ca urmare a obtinerii unui rezultat in afara specificatiei la parametrul "Dizolvare" SOLPADEINE EXTRA 500 mg/12,8 mg/30 mg comprimate efervescente 500 mg/12,8 mg/30 mg combinatii Glaxosmithkline Ltd, Irlanda/Hipocrate 2000 SRL , retragere de pe, ca urmare a identificarii unei neconformitati de calitate in urma reclamatiilor primite de la pacienti (nu a fost respectata compozitia calitativa si cantitativa, conf. APP nr. 9796/2017/01-07) NUTRIFLEX OMEGA SPECIAL emulsie perfuzabila combinatii (1000 ml solutie aminoacizi, 500 ml emulsie lipidica, 1000 ml solutie glucoza) B.Braun Melsungen AG, Germania , aparitia unui posibil rezultat in afara specificatiei pentru camera solutiei de glucoza MILLIGEST drajeuri combinatii (etinilestradiol/ gestoden) Gedeon Richter PLC, CITROLIN apa de gura diverse Pharco Impex 93 SRL Z91001B retragere de pe, ca urmare a identificarii unei neconformitati de calitate pentru o alta serie de produs (prezenta unui blister care continea 22 drajeuri in loc de 21 drajeuri), neconformitate de retragere de pe, ca urmare a identificarii unei neconformitati de calitate sesizata de un utilizator (la deschiderea flaconului, capacul de plastic s-a spart); in plus s-a constatat faptul ca nu au fost posibila reambalare a seriei (dupa acordul ANMDM)- acord ANMDMR pentru comercializare /
8 HEPARINA SODICA PANPHARMA 5000 UI/ml solutie injectabila 5000 UI/ml heparina Panpharma, Franta , , , retragere de pe, ca urmare a declansarii unei alerte rapide de catre autoritatea din Germania, in urma identificarii de catre producator a unei neconformitati semnalata pe linia de fabricatie VIBROCIL 2,5 mg/0,25 mg/g gel nazal 2,5 mg/0,25 mg/g maleat de dimetinden/ fenilefrina Novartis Consumer Health GmbH, Germania/ GSK Consumer Healthcare SRL T03642A, U05167B retragere de pe, ca urmare a expirarii perioadei de un an de la deciziei de intrerupere a APP nr. 6036/2005/ PENTOXI RETARD 400 mg comprimate cu eliberare prelungita 400 mg pentoxifilin Terapia SA retragere de pe, ca urmare a obtinerii unui rezultat in afara specificatiei la parametrul "Dizolvare" EURESPAL 80 mg comprimate cu eliberare prelungita 80 mg fenspirid EURESPAL 2 mg/2 ml sirop 2 mg/2 ml fenspirid Les Lab. Servier Ind. Franta/Les Laboratoires Servier Franta Les Lab. Servier Ind. Franta/Les Laboratoires Servier Franta retragere de pe, ca urmare a declansarii procedurii de urgenta de catre autoritatea de reglementare franceza (ANSM) la nivelul UE, discutata la reuniunea din februarie 2019 a Comitetului retragere de pe, ca urmare a declansarii procedurii de urgenta de catre autoritatea de reglementare franceza (ANSM) la nivelul UE, discutata la reuniunea din februarie 2019 a Comitetului VITAMEDI-C 750 mg/5 ml solutie injectabila 750 mg/5 ml acid ascorbic Pascoe Pharmazeutische Praparate GmbH, Germania 9368 retragere de pe, ca urmare a declansarii unei alerte rapide de catre autoritatea din Germania, in urma identificarii de catre producator a unei neconformitati semnalata pe linia de fabricatie EPISTAT 80 mg comprimate cu eliberare prelungita 80 mg fenspirid Gedeon Richter SA retragere de pe, ca urmare a declansarii procedurii de urgenta de catre autoritatea de reglementare franceza (ANSM) la nivelul UE, discutata la reuniunea din februarie 2019 a Comitetului SEROQUEL XR 200 mg comprimate cu eliberare prelungita 200 mg quetiapina Astrazeneca UK Ltd/ Astrazeneca AB, Suedia intreruperedefinitiva a comercializarii, ca urmare a eliminarii produsului din CaNaMed si din Catalogul Public incepand cu
9 SEROQUEL XR 300 mg comprimate cu eliberare prelungita 300 mg quetiapina Astrazeneca UK Ltd/ Astrazeneca AB, Suedia intreruperedefinitiva a comercializarii, ca urmare a eliminarii produsului din CaNaMed si din Catalogul Public incepand cu SEROQUEL XR 400 mg comprimate cu eliberare prelungita 400 mg quetiapina Astrazeneca UK Ltd/ Astrazeneca AB, Suedia intreruperedefinitiva a comercializarii, ca urmare a eliminarii produsului din CaNaMed si din Catalogul Public incepand cu ALVESCO 80 INHALER solutie de inhalat presurizata 80µg/doza ciclesonid Takeda GmbH, Germania/Astrazeneca AB, Suedia intreruperedefinitiva a comercializarii, ca urmare a eliminarii produsului din CaNaMed si din Catalogul Public incepand cu PLENDIL 2,5 mg comprimate cu eliberare prelungita 2,5 mg felodipina Astrazeneca AB, Germania/ Astrazeneca AB, Suedia intreruperedefinitiva a comercializarii, ca urmare a eliminarii produsului din CaNaMed si din Catalogul Public incepand cu ESCITIL 10 mg x 28 cpr. film. comprimate filmate 10 mg escitalopram Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EXPLEMED 10 mg x 28 cpr. comprimate 10 mg aripiprazol Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EXPLEMED 15 mg x 28 cpr. comprimate 15 mg aripiprazol Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu
10 KETILEPT 100 mg x 60 cpr. film. comprimate filmate 100 mg quetiapina Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu KETILEPT 200 mg x 60 cpr. film. comprimate filmate 200 mg quetiapina Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu KETILEPT 300 mg x 60 cpr. film. comprimate filmate 300 mg quetiapina Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu LUCETAM 800 mg x 20 cpr. film. comprimate filmate 800 mg piracetam Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu LUCETAM 1200 mg x 20 cpr. film. comprimate filmate 1200 mg piracetam Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu LUCETAM 400 mg x 20 cpr. film. comprimate filmate 400 mg piracetam Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu PERITOL 4 mg x 20 cpr. comprimate 4 mg ciproheptadina Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu TELMISARTAN/HIDROCLOROTIAZIDA EGIS 80 mg/12,5 mg x 28 cpr. comprimate 80 mg/12,5 mg combinatii (telmisartan+ hidroclorotiazida) Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu
11 EGIRAMLON 10 mg/10 mg x 100 cps. capsule 10 mg/10 mg combinatii (ramipril+ amlodipina) Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EGIRAMLON 10 mg/5 mg x 100 cps. capsule 10 mg/5 mg combinatii (ramipril+ amlodipina) Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EGIRAMLON 5 mg/10 mg x 100 cps. capsule 5 mg/10 mg combinatii (ramipril+ amlodipina) Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EGIRAMLON 5 mg/5 mg x 100 cps. capsule 5 mg/5 mg combinatii (ramipril+ amlodipina) Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu EGILOK 25 mg x 20 cpr. comprimate 25 mg metoprolol Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu CLOSTILBEGYT 50 mg x 10 cpr. comprimate 50 mg clomifen Egis Pharmaceuticals PLC, intrerupere temporara a comercializarii si eliminare din CaNaMed si din Catalogul Public incepand cu
12 OZURDEX implant intravitreal 700 µg dexametazona Allergan Pharmaceuticals International Ltd. Irlanda E78726 particule de silicon identificate in unele implanturi Retragere voluntara la nivel de farmacie/farmacie de spital/clinica si CEFOZON 1g pulbere pentru solutie injectabila/perfuzabila i.m./i.v. 1 g cefoperazon Felsin Farm S.R.L. Romania/ E.I.P.I.C.O. Med S.R.L., Romania neconformitate de calitate confirmata (aparitia unui precipitat alb-galbui la dizolvarea imediata in solvent, precum si aparitia unei spumificari la administrarea in solutie perfuzabilala de Ser fiziologic 0,9% 100 ml cu marirea timpului de curgere a solutiei perfuzabile) HALDOL 5 mg comprimate 5 mg haloperidol Janssen Pharmaceutica N.V. Belgia toate seriile aflate in perioada de valabilitate incetare definitiva a punerii pe, din motive comerciale NUTRIFLEX OMEGA SPECIAL emulsie perfuzabila combinatii (1000 ml solutie aminoacizi, 500 ml emulsie lipidica, 1000 ml solutie glucoza) B.Braun Melsungen AG, Germania (exp ) aparitia unui posibil rezultat in afara specificatiei pentru camera solutiei de glucoza MODERIBA 200 mg comprimate filmate 200 mg ribavirina Abbvie Deutschland GmbH, Germania/ Abbvie Ltd, Marea Britanie toate seriile incetare definitiva a punerii pe, din motive comerciale
13 MODERIBA 400 mg comprimate filmate 400 mg ribavirina Abbvie Deutschland GmbH, Germania/ Abbvie Ltd, Marea Britanie toate seriile incetare definitiva a punerii pe, din motive comerciale MODERIBA 600 mg comprimate filmate 600 mg ribavirina Abbvie Deutschland GmbH, Germania/ Abbvie Ltd, Marea Britanie toate seriile incetare definitiva a punerii pe, din motive comerciale VALSARTAN HIDROCLOROTIAZIDA TORRENT 160mg/12,5mg comprimate filmate 160mg/12,5mg valsartan + hidroclorotiazida Heumann Pharma GmbH, Germania/ Torrent Pharma SRL, Romania toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential VALSARTAN HIDROCLOROTIAZIDA TORRENT 80mg/12,5mg comprimate filmate 80mg/12,5mg valsartan + hidroclorotiazida Heumann Pharma GmbH, Germania/ Torrent Pharma SRL, Romania toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential carcinogenic provenita din procesul de fabricatie al substantei active VALSARTAN TORRENT 80mg comprimate filmate 80 mg valsartan Heumann Pharma GmbH, Germania/ Torrent Pharma SRL, Romania toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential carcinogenic provenita din procesul de fabricatie al substantei active
14 VALSARTAN TORRENT 160mg comprimate filmate 160 mg valsartan Heumann Pharma GmbH, Germania/ Torrent Pharma SRL, Romania toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential carcinogenic provenita din procesul de fabricatie al substantei active VALSARTAN ZENTIVA 80mg comprimate filmate 80 mg valsartan Sanofi Aventis Polonia/ Zentiva KS Rep. Ceha toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential carcinogenic provenita din procesul de fabricatie al substantei active VALSARTAN ZENTIVA 160mg comprimate filmate 160 mg valsartan Sanofi Aventis Polonia/ Zentiva KS Rep. Ceha toate seriile retragerea de pe ca masura de precautie a medicamentelor care contin substanta activa valsartan fabricata de producatorul Zheijiang Huahai Pharmaceuticals din China, ca urmare a detectarii unor cantitati variabile dintr-o impuritate cu potential carcinogenic provenita din procesul de fabricatie al substantei active PARACOF 300 mg/30 mg comprimate 300 mg/ 30 mg combinatii (paracetamol + cafeina) Sintofarm S.A., Romania S serie de produs retrasa ca urmare a lipsei cate unui blister din 7 ambalaje secundare VORICONAZOL FRESENIUS KABI 200 mg pulbere pentru solutie perfuzabila 200 mg voriconazol Fresenius Kabi Deutschland GmbH Germania/Fresenius Kabi Romania S.R.L. 50KEH006 (exp ) modificarilor la APP nr. 8129/2015/01 ( )
15 METOCLOPRAMID SLAVIA 10 mg comprimate 10 mg metoclopramid Arena Group S.A./ Slavia Pharm S.R.L. 60 (exp ), 61 (exp ), 62 (exp ), 63 (exp ), 64 (exp ), 65 (exp ), 66 (exp ), 67 (exp ), 68 (exp ), 69 (exp ) modificarilor la APP nr. 8859/2016/01 ( ) OSSEOR granule pentru suspensie orala 2 g ranelat de strontiu Les Laboratoires Servier Franta toate seriile incetare definitiva a punerii pe, din motive comerciale PANADOL ARTRO comprimate cu eliberare prelungita 665 mg paracetamol GSK Dungarvan Ltd Irlanda/GSK Consumer Healthcare Romania SRL toate seriile suspendarea APP 6231/2014/01-04, urmare a deciziei Comisiei C(2018)1151 din de suspendare a APP pentru medicamentele care contin substanta activa "paracetamol cu eliberare modificata si prelungita" DORETA EP comprimate cu eliberare prelungita 75 mg/650 mg combinatii (tramadol + paracetamol) KRKA Novo Mesto DD Slovenia toate seriile suspendarea APP 8527/2016/01-14, urmare a deciziei Comisiei C(2018)1151 din de suspendare a APP pentru medicamentele care contin substanta activa "paracetamol cu eliberare modificata si prelungita" FLOXAL 3mg/ml picaturi oftalmice, solutie 3 mg/ml ofloxacina Dr. Gerhard Mann Chem Pharm Fabrik GmbH, Germania 705, 725, 776, 796, 816, 836, 866 (APP 5040/2004/01) schimbarii APP ( ) FLOXAL 3mg/g unguent oftalmic 3mg/g ofloxacina Dr. Gerhard Mann Chem Pharm Fabrik GmbH, Germania 235, 285, 365, 385, 395, 475, 515, 545, 576, 636 (APP 5039/2004/01) schimbarii APP ( )
16 LYNPARZA capsule 50 mg olaparib Astra Zeneca UK, Marea Britanie/ Astra Zeneca AB, Suedia NG656, NF300 serii de produs pentru care s-a obtinut un rezultat in afara specificatiei pentru "forma polimorfa L" Retragere voluntara la nivel de farmacie/spital si BONDULC 40µg/ml picaturi oftalmice, solutie 40µg/ml travoprost Pharmaten SA Grecia, Balkan Pharma AD Bulgaria/Actavis Group PTC EHF Islanda 1TR030415A (exp ) serie de produs distribuita in Romania din seria vrac 1TR030415, pentru care Autoritatea Competenta din Polonia a emis o Alerta rapida referitoare la o neconformitate de calitate care consta in scurgeri de lichid din flacon, seria si data de expirare inscriptionate pe ambalajul primar devenind ilizibile. Retragere de pe la nivel de farmacii si PARACOF 300 mg/30 mg comprimate 300 mg/ 30 mg combinatii (paracetamol + cafeina) Sintofarm S.A., Romania S serie de produs retrasa, ca urmare a sesizarii primite de la distribuitorul Farmexpert DCI privind lipsa cate unui blister din 7 ambalaje secundare Retragerea din depozite si farmacii, cu posibilitatea reambalarii, cu conditia furnizarii de catre producator a unor informatii suplimentare referitoare la evaluarea riscului asupra calitatii produsului DUOFILM solutie cutanata combinatii Stiefel Laboratories Ltd. Irlanda/GSK Consumer Healthcare SRL, Romania C1B43 modificarii APP ( ) XTANDI 40 mg capsule moi 40 mg enzalutamida Astelas Pharma Europe B.V., Olanda 17C0623 produs (66 cutii) cu ambalaj si prospect bilingv sloveno-croat livrat in locul altei serii distribuitorului Mediplus Exim SRL, retras la nivel de farmacie/pacient Retragere voluntara la nivel de farmacie/ pacient si LISINOPRIL SANDOZ 20mg comprimate 20 mg lisinopril Salutas Pharma GmbH, Germania/ Hexal AG, Germania toate seriile cu APP nr. 6107/2005/01 schimbarii APP ( ) DUODART 0,5 mg/0,4 mg capsule 0,5 mg/0,4 mg combinatii (dutasterida+ tamsulosina) Catalent Germany Schorndorf GmbH, Germania/GSK SRL Romania seria F( APP nr. 2641/ ) schimbarii APP ( )
17 URICOL 5 g granule efervescente 5 g combinatii Pharco Impex ' 93 S.R.L. toate seriile produs pentru care cererea de reiinoire a APP a fost radiata in PANADOL BABY 120 mg/ 5ml suspensie orala 120 mg/ 5ml paracetamol Farmaclair Franta/GSK Consumer Healthcare Marea Britanie P025, P026, P052, P054, P055, P062, P063, P064, P087, P088, P089, P090, P091, P109, P110, P111, P112, P113, P140, P141, P142, P147, P148, P149, P150, P181, P182, P183, P198, P199, P200, R012, R013, R015, R016, R017, R018 modificarilor la APP din THERAFLU MAX RACEALA SI TUSE pulbere pentru solutie orala 1000 mg/200 mg/ 12,2 mg paracetamol, guaifenesina, fenilefrina Novartis Consumer Health GmbH Germania/ GSK Consumer Healthcare SRL Romania ALPRAZOLAM 0,25 mg comprimate 0,25 mg alprazolam Labormed Pharma S.A. 7EW0181, 7EW0182, 7EW0189, 7EW0208, 7EW0209, 7EW0214, 7EW0220, 7EW0221, 7GW0116, 7GW , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , posibila prezenta de particule metalice din otel inox in cateva ambalaje de produs finit produs pentru care s-au obtinut rezultate in afara specificatiei la parametrii "impuritate individuala" si "impuritati totale" la finalul perioadei de valabiltate pentru anumite serii, celelalte serii fiind retrase, ca masura de precautie
18 ALPRAZOLAM 0,50 mg comprimate 0,50 mg alprazolam Labormed Pharma S.A. VIBROCIL DUO 0,5 mg/ml+0,6 mg/ml CLORURA DE POTASIU 74,56 mg/ml spray nazal solutie concentrat pentru solutie perfuzabila 0.5 mg/ml + 0,6 mg/ml xylometazolina+ ipratropiu 74,56 mg/ml clorura de potasiu Novartis Consumer Health GmbH Germania/ GSK Consumer Healthcare SRL Romania B.Braun Melsungen AG Germania , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , T02622B, T03602D , , , , produs pentru care s-au obtinut rezultate in afara specificatiei la parametrii "impuritate individuala" si "impuritati totale" la finalul perioadei de vlabiltate pentru anumite serii, celelalte serii fiind retrase ca masura de precautie termenul de 1 an (prevazut de OMS nr. 1810/2006) dupa modificarilor la APP din serii de produs pentru care s-a observat posibila formare de particule in stadii incipiente in concentratul pentru solutii perfuzabile
19 OMEPRAZOL LPH 20 mg capsule gastrorezistente 20 mg omeprazol Labormed Pharma S.A , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , produs pentru care s-a obtinut un rezultat neconform pentru parametrul "dizolvare" la una din serii in timpul studiilor de stabilitate, celelalte serii fiind retrase, ca masura de precautie EGOLANZA 15 mg comprimate filmate 15 mg olanzapina Egis Pharmaceuticals PLC toate seriile cu APP nr. 2828/2010/01 schimbarii APP ( ) EGOLANZA 20 mg comprimate filmate 20 mg olanzapina Egis Pharmaceuticals PLC toate seriile cu APP nr. 2829/2010/01 schimbarii APP ( ) FLERADAY 500 mg comprimate filmate 500 mg levofloxacina Dr. Reddy's Laboratories Ltd Marea Britanie/Dr. Reddy's Laboratories Romania SRL C produs retras ca urmare a eliberarii eronate de la nivelul antrepozitului vamal catre un distribuitor angro a unei cantitati de 2100 cutii fara certificat de eliberare al seriei semnat de persoana calificata
20 SCOBUTIL 10 mg comprimate 10 mg bromura de butilscopolamoniu Takeda Pharma SP. Z.O.O. Polonia/ Takeda GmbH Germania , , , , , , produs pentru care s-a obtinut un rezultat in afara specificatiei in timpul studiilor de stabilitate in ceea ce priveste uniformitatea substantei active la nivel de comprimat pentru una din serii, celelalte serii fiind retrase, ca masura de precautie DRILL MIERE CU AROMA DE TRANDAFIR 3 mg+ 0,2 mg pastile 3 mg+ 0,2 mg combinatii DRILL FARA ZAHAR 3 mg+ 0,2 mg pastile 3 mg+ 0,2 mg combinatii DRILL 3 mg+ 0,2 mg pastile 3 mg+ 0,2 mg combinatii PARASINUS PENTA DUOFILM VIBROCIL DUO 0,5 mg/ml+0,6 mg/ml comprimate solutie cutanata spray nazal solutie 500 mg/25mg/5 mg/20mg/38 mg 167 mg/g mg/g 0,5 mg/ml+ 0,6 mg/ml combinatii (paracetamol+co feina+fenilefrina+ terpinhidrat+ac. ascorbic) combinatii (acid salicilic + acid lactic) xylometazolina+ ipratropiu FENISTIL gel 1 mg/g gel 1 mg/g dimetinden Pierre Fabre Medicament Production Franta/ Pierre Fabre Medicament Franta Pierre Fabre Medicament Production Franta/ Pierre Fabre Medicament Franta Pierre Fabre Medicament Production Franta/ Pierre Fabre Medicament Franta GSK Dungarvan Ltd Irllanda/ GSK Consumer Healthcare UK Stiefel Laboratories Ireland LTD/GSK Consumer Healthcare SRL Romania Novartis Consumer Health GmbH Germania/ GSK Consumer Healthcare SRL Romania Novartis Consumer Health GmbH Germania/ GSK Consumer Healthcare SRL Romania A00519, A00521, A00532, A00536 A00455, A00455-A, A00456, A00457, A00459 A01333, A01338, A01343, A , 025, 026, 027, 028, 029, 030, 031, 032, 033, 034, 035, 036, 037, 038, 039, 040, 041, 042, 043, 044, 045, 046, 047, 048, 049, 050, 051, 052, 5001, 5002, 6201, 6202, T, 866T, 1111T R02711E, R04347A, R04353B R02394B, R02869A, T00538A, T00539A, T00540A, T00541A, T00734A, T01115A, T01116A, T01308B, T01309A, T01310A, T01311A, T01740A, T01741A, T01742A, T01743A, T02155A, T02156A, T04244B, T04246A, T04247A, T04248A, T04249A, T04250A, T04251A. modificarilor la APP din modificarilor la APP din modificarilor la APP din modificarilor la APP din modificarilor la APP din modificarilor la APP din termenul de 1 an (prevazut de OMS nr. 1810/2006) dupa modificarilor la APP din
21 TYVERB 250mg comprimate filmate 250 mg lapatinib PANADOL 500 mg comprimate filmate 500 mg paracetamol VENTOLIN 0,5 mg/ml solutie injectabila 0,5 mg/ml salbutamol LAMISIL crema 10 mg/g crema 10 mg/g terbinafina Glaxo Operation UK Ltd/ Novartis Europharm Ltd UK GSK Dungarvan Ltd Irllanda/ GSK Consumer Healthcare UK GSK Manufacturing SPA Italia/ Glaxo Wellcome UK Ltd Novartis Consumer Health GmbH Germania/ GSK Consumer Healthcare SRL Romania R94G 025, 027, 028, 029, 030, 031, 032, 033, 034, 035, 036, 037, 038, 039, 040, 041, 042, 043, 044, 045, 046, 047, 048, 049, 050, 051, , 5502, 4513AB, 4513A, 4513, 4510C, 4510B R01610A, R02892A, R03501B produs pentru care a incetat valabilitatea codului CIM W incepand cu modificarilor la APP din modificarilor la APP modificarilor la APP din SULFAT DE ATROPINA TAKEDA 1 mg/ml solutie injectabila 1mg/ml sulfat de atropina Takeda GmbH Austria/ Takeda GmbH Germania produs pentru care la finalizarea testelor de stabilitate de rutina s-a observat obtinerea unui rezultat in afara specificatiei la parametrul "acid tropic" Retragere voluntara (ca masura de precautie a seriei ) si AUGMENTIN ES 600mg/42,9mg/ 5ml pulbere pentru suspensie orala 600mg/42,9mg/5ml amoxilcilina+acid clavulanic IRBESARTAN HF 300 mg cpr filmate 300 mg irbesartan Smithkline Beecham Pharmaceuticals UK/ Smithkline Beecham Ltd UK Stada Arzneimittel AG Germania/ Stada Hemofarm SRL Romania 1515, modificarilor la APP reautorizare IRBESARTAN HF 150 mg cpr filmate 150 mg irbesartan Stada Arzneimittel AG Germania/ Stada Hemofarm SRL Romania reautorizare
22 FORTUM 1g pulb pt sol injectabila 1 g ceftazidim Glaxo WellcomeUK Ltd M Britanie U952, V086, V155, V532 produs pentru care a incetat valabilitatea APP, incepand cu CATHEJELL cu LIDOCAINA gel uretral combinatii Pharmazeutische Fabrik Montavit GES. M.B.H., Austria 2951 unele ambalaje secundare nu au inscriptionat lotul si data de expirare TEZEO HCT 80mg/25mg cpr 80mg/25mg combinatii (telmisartan+hidroclorotia zida) Zentiva S.A. Romania/Zentiva K.S. Rep. Ceha produs pentru care s-au obtinut rezultate in afara specificatiilor in timpul studiilor de stabilitate efectuate in conditii normale Retragere voluntara (ca masura de precautie) si WARTEC 1,5 mg/g crema 1,5 mg/g podofilotoxina Stiefel Lab (Ireland)Ltd/ GSK SRL Romania 893R aprobarea de catre ANMDM ( ) a modificarilor la APP nr. 7372/2006/ MUCOSOLVAN 15 mg guma orala 15 mg ambroxol Boehringer Ingelheim Int GmbH Germania toate seriile produs pentru care s-au obtinut rezultate in afara specificatiei in timpul studiilor de stabilitate efectuate pe serii care nu au fost importate in Romania Retragere voluntara (ca masura de precautie) si MAALOX 35mg/40mg/ml susp orala 35mg/40mg/ml combinatii TAKEDA GmbH Germania produs pentru care s-a obtinut un rezultat în afara specificatei de la eliberare la parametrul "continut de hidroxibenzoat-4-metil", PROPRANOLOL 40 mg cpr 40 mg propranolol Sintofarm SA W lipsa a 2 blistere din ambalajul secundar in 7 unitati comerciale reambalare OROFAR 1 mg/ 1 mg cpr de supt 1 mg/1mg combinatii Kemwell AB Suedia/GSK Consumer Healthcare SRL, Romania ORA15011, ORA15012, ORA15048, ORA15049, ORA15072, ORA15073, ORA15074 reautorizare (în data de )
23 OMERAN 20 mg cps gastrorezis tente 20 mg omeprazol Laboratorios Linconsa SA Spania/ GSK SRL Romania LC21804, LC21812, LC24320, LC24336, LC25065, LC24986, LC25394, LC25393, LC25202, LC5054 aprobarea de catre ANMDM (în data de ) a modificarilor la APP nr. 7785/2006/ VOTRIENT 400 mg cpr filmate 400 mg pazopanib TAFINLAR 75 mg cps. 75 mg dabrafenib TAFINLAR 50mg cps. 50 mg dabrafenib REVOLADE 50mg cpr filmate 50mg eltrombopag REVOLADE 25mg cpr filmate 25 mg eltrombopag HYCAMTIN 1 mg cps. 1 mg topotecam INKONTAN 30 mg cpr. filmate 30 mg trospium INKONTAN 15 mg cpr. filmate 15 mg trospium Glaxo Operations UK Ltd/ Novartis Europharm Ltd Marea Britanie Glaxo Wellcome SA Spania/ Novartis Europharm Ltd Marea Britanie Glaxo Wellcome SA Spania/ Novartis Europharm Ltd Marea Britanie Glaxo Operations UK Ltd/ Novartis Europharm Ltd Marea Britanie Glaxo Operations UK Ltd/ Novartis Europharm Ltd Marea Britanie GSK Manufacturing SPA Italia/ Novartis Europharm Ltd Marea Britanie Pharmazeutische Fabrik Montavit GES. M.B.H., Austria Pharmazeutische Fabrik Montavit GES. M.B.H., Austria MY2A, P64U, TL7M, TA5T, VN2D M83U, RD6N, U94S, U94T, WP5B YM9P RB4F, FT9S, J56F, UD6Y F48V, YR2X, LU9K, RR4B 5501, 4504B, 5503, 5503A, 5505, 5506A, 5506, 5506B 61602, 62143, 63250, 63618, 65358, 66994, 66994a 61781, 62137, 63238, 63674, 64299, 64715, 65685, 66753, 66754, REUPROFEN 400 mg cpr. filmate 400 mg ibuprofen AC Helcor SRL OTOCALM pic. auriculare 6,25g/1,5g/ 100 ml combinatii DERMODRIN unguent 20 mg/g difenhidramina Pharco Egipt/Pharco Impex 93 SRL Pharmazeutische Fabrik Montavit GES. M.B.H., Austria toate seriile 1097, 1103, 1108 produs pentru care a incetat valabilitatea codului CIM W incepand cu produs pentru care a incetat valabilitatea codului CIM W incepand cu produs pentru care a incetat valabilitatea codului CIM W incepand cu produs pentru care a incetat valabilitatea codului CIM W incepand cu produs pentru care a incetat valabilitatea codului CIM W incepand cu produs pentru care a incetat valabilitatea codului CIM W incepand cu reautorizare (în data de ) reautorizare (în data de ) rezultate in afara specificatiei obtinute la parametrul,,subst inrudite chimic, g% alte impuritati, individual si total" produs pentru care a incetat valabilitatea APP, incepand cu reautorizare (în data de )
24 SINECOD 7,5mg/5ml sirop 7,5mg/5ml butamirat Novartis Consumer Health GmbH, Germania/GSK Consumer Healthcare SRL Romania M02647A, M03693A, N03483A, N05151A, P01933A, P02959B, P04920A, P05753A, R02075A, R03174A aprobarea de catre ANMDM (în data de ) a modificarilor la APP nr. 5314/2005/ SEVO-ANESTERAN lichid pt vapori de inhalat sevofluran Rompharm Company SRL unele flacoane au inelul de conexiune cu valva montat invers pe gatul flaconului astfel incat pinii valvei nu se potrivesc cu inelul. Ca urmare, flacoanele respective nu pot fi conectate la dispozitivul medical in vederea administrarii verificare a tuturor flacoanelor si punerea pe doar a flacoanelor corespunzatoare ALBIOMIN 50g/l, 200g/l sol perfuzabila 50g/l, 200g/l albumina umana BLEOMYCIN MYLAN 15000UI pulb si solv pt sol inj UI bleomicina Biotest Pharma GmbH Germania Parasfarma SL Spania (solvent), Nilppon Kayaku Co.Ltd.Japonia (fl cu bleomicin)/mylan Pharmaceuticals SL J8J4 produs posibil contaminat cu etilenglicol produs pt care s-a semnalat prezenta de particule de sticla in pulbere Retragere Retragere COLDREX JUNIOR HOT REM 300mg/20mg/5mg pulbere pt. susp. orala 300mg/20mg/5mg combinatii Smithkline Beecham SA Spania/Hipocrate 2000 SRL Romania 4802, 4804, 4805, 4807, 4810, 4701, 5001, 5002, 5004, 5007, 5010, 5013, 6202, 6201 termenul de un an de la aprobarea transferului de APP de la GSK Consumer Healthcare - Marea Britanie la Hipocrate 2000 SRL conform OMS 1810/ ,05,2017 COLDREX JUNIOR 250mg/100mg/5mg cpr. filmate 250mg/ 100mg/ 5mg combinatii Famar SA Grecia/Hipocrate 2000 SRL Romania 4004, 4613, 4635, 4657, 4683, 5820, 5827, 5830, 5901, 5914, 5921, 6212 termenul de un an de la aprobarea transferului de APP de la GSK Consumer Healthcare - Marea Britanie la Hipocrate 2000 SRL conform OMS 1810/ ,05,2017 COLDREX HONEY & LEMON pulbere pt. susp. orala 750mg/60mg/10mg combinatii Smithkline Beecham SA Spania/Hipocrate 2000 SRL Romania 5002, 5006, 5009, 5024, 5025 termenul de un an de la aprobarea transferului de APP de la GSK Consumer Healthcare - Marea Britanie la Hipocrate 2000 SRL conform OMS 1810/ COLDREX LEMON pulbere pt. susp. orala combinatii Smithkline Beecham SA Spania/Hipocrate 2000 SRL Romania 4007, 4601, 4605, 4606, 4607, 4613, 4614, 4615, 4618, 4624, 4501, 4504, 4505, 4652, 4653, 4655, 4658, 4659, 4660, 4801, 4803, 4804, 5002, 5005, 5006, 5011, 5016, 5017, 5022, 5005, 5006, 5011, 5016, 5017, 5027, 5039, 5057, 6201, 6202 termenul de un an de la aprobarea transferului de APP de la GSK Consumer Healthcare - Marea Britanie la Hipocrate 2000 SRL conform OMS 1810/
25 COLDREX MAXGRIP LEMON pulbere pt. susp. orala combinatii Smithkline Beecham SA Spania/Hipocrate 2000 SRL Romania 4609, 4613, 4614, 4620, 4626, 4627, 4628, 4631, 4654, 4656, 4657, 4658, 4660, 4662, 4661, 4663, 4664, 4665, 4666, 4667, 4669, 4670, 4671, 4673, 4674, 4675, 4802, 4803, 4804, 4805, 4814, 4815, 4818, 4819, 5016, 5017, 5018, 5019, 5027, 5028, 5029, 5030, 5031, 5032, 5033, 5034, 5005, 5036, 5038,5039, 5006, 5047, 5001, 5002, 5048, 5301, 5302, 5049, 5051, 5050, 5318, 5319, 5320, 5327, 5328, 5329, 5335, 5337, 5058, 5338, 5059, 5336, 6203, 6204, 6208, 6209, 6211 termenul de un an de la aprobarea transferului de APP de la GSK Consumer Healthcare - Marea Britanie la Hipocrate 2000 SRL conform OMS 1810/ PANADOL EXTRA cpr. filmate 500mg/65mg combinatii GSK Dungarvan Ltd. Irlanda/GSK Consumer Healthcare Marea Britanie KW9H aprobarea de catre ANMDM (în data de ) a modificarilor la APP nr. 5550/2005/ VOLTAREN FORTE 23,2 mg/g gel 23,2 mg/g diclofenac Novartis Consumer Health GmbH, Germania/GSK Consumer Healthcare SRL Romania R02294B, R02295A,, R03222A, R03223A, R03982A, R04295A, R04899B. R04911A, R05477B, T00001A, T00002A, T00003A, T00741A, T00742A, T00743A, T00744A, T01491A, T01492A, T01493A, T01494A, T01495A termenul de un an de la aprobarea transferului de APP de la Novartis Consumer Health GmbH catre GSK Consumer Healthcare SRL conform OMS 1810/ VOLTAREN EMULGEL 11,6 mg/g gel 11,6 mg/g diclofenac Novartis Consumer Health GmbH, Germania/GSK Consumer Healthcare SRL Romania W7392, W7393, W7394, W7395, W7396, W7397, W7398, W7399, W7400, W7401, W7402, W7403, W7404, W7405, W7406, W7407, W7408, W7409, W7410, W7411, termenul de un an de la aprobarea W7412, W7413, WC368, transferului de APP de la Novartis WC369, WC370, WC671, WC672, WC673, W0036, Consumer Health GmbH catre W0037, W0038, W0039, W0040, GSK Consumer Healthcare SRL W0041, W0042, W0043, conform OMS 1810/2006 W0044, W0045, W0046, W0047, W0048, W0049, W0050, WC363, WC364, WC365, WC366, VENORUTON 300 mg cps. 300 mg troxerutin Kemwell AB Suedia/GSK Consumer Healthcare SRL, Romania VCA14015A modificarilor la APP din si THERAFLU SINUS RACEALA SI GRIPA pulbere pt. sol. orala 650 mg/10mg combinatii (paracetamol+ fenilefrina) Famar, Franta/GSK Consumer Healthcare SRL, Romania H4547, H4774, H5720, H5721, H6062, H6063, H6085, H6086, H6065, H6087, H6204, H6205, H6209, H6502, H6504, H3988 termenul de un an de la aprobarea transferului de APP de la Novartis Consumer Health GmbH catre GSK Consumer Healthcare SRL conform OMS 1810/
MINISTERUL SĂNĂTĂȚII AGENȚIA NAȚIONALĂ A MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Departamentul de Evaluare a Tehnologiilor Medicale Str. Aviator S
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE I: ACIDUM IBANDRONICUM INDICAȚIA: TRATAMENTUL OSTEOPOROZEI LA PACIENTELE ÎN POSTMENOPAUZĂ CU RISC CRESCUT DE FRACTURĂ Reducerea riscului fracturilor vertebrale
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE I: ACIDUM IBANDRONICUM INDICAȚIA: TRATAMENTUL OSTEOPOROZEI LA PACIENTELE ÎN POSTMENOPAUZĂ CU RISC CRESCUT DE FRACTURĂ Reducerea riscului fracturilor vertebrale
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZ
 ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori angro/en detail, deținători de autorizații de punere pe piață - me
 Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 02.04.2019 Nr. crt. Unitatea
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 02.04.2019 Nr. crt. Unitatea
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 5000/2012/ Anexa 1 Prospect Prospect: informaţii pentru pacient Aprokam 50 mg, pulbere pentru soluţie injec
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 5000/2012/01-02-03 Anexa 1 Prospect Prospect: informaţii pentru pacient Aprokam 50 mg, pulbere pentru soluţie injectabilă Cefuroximă Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 5000/2012/01-02-03 Anexa 1 Prospect Prospect: informaţii pentru pacient Aprokam 50 mg, pulbere pentru soluţie injectabilă Cefuroximă Citiţi cu atenţie şi în întregime
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori angro/en detail, deținători de autorizații de punere pe piață - me
 Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 04.06.2019 Nr. crt. Unitatea
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 04.06.2019 Nr. crt. Unitatea
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZ
 ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori angro/en detail, deținători de autorizații de punere pe piață - me
 Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 23.07.2019 Nr. crt. Unitatea
Tabel cu unitațile sancționate contravenționale de ANMDM (fabricanți, distribuitori /en detail, deținători de autorizații de punere pe piață - medicamente de uz uman) actualizat 23.07.2019 Nr. crt. Unitatea
„ÎNREGISTRAT”
 ÎNREGISTRAT Ministerul Justiţiei Nr. de 768 din 09 iulie 2010 Alexandru TĂNASE MINISTERUL SĂNĂTĂŢII AL REPUBLICII MOLDOVA МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ МОЛДОВА 01 iulie 2010 O R D I N mun. Chişinău
ÎNREGISTRAT Ministerul Justiţiei Nr. de 768 din 09 iulie 2010 Alexandru TĂNASE MINISTERUL SĂNĂTĂŢII AL REPUBLICII MOLDOVA МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ МОЛДОВА 01 iulie 2010 O R D I N mun. Chişinău
CU 1 FLAC. DIN PEÎD, DE CAPACITATE 60 ML, PREVAZUT CU SISTEM DE ÎNCHIDERE SECURIZAT PENTRU COPII, CE CONTINE PULB. PENTRU 35 ML SUSP. ORALA SI O SERIN
 CU 1 FLAC. DIN PEÎD, DE CAPACITATE 60 ML, PREVAZUT CU SISTEM DE ÎNCHIDERE SECURIZAT PENTRU COPII, CE CONTINE PULB. PENTRU 35 ML SUSP. ORALA SI O SERINGA DIN PP DE 5 ML CU MARCAJ LA FIECARE 0,2 ML PRF ANEXA
CU 1 FLAC. DIN PEÎD, DE CAPACITATE 60 ML, PREVAZUT CU SISTEM DE ÎNCHIDERE SECURIZAT PENTRU COPII, CE CONTINE PULB. PENTRU 35 ML SUSP. ORALA SI O SERINGA DIN PP DE 5 ML CU MARCAJ LA FIECARE 0,2 ML PRF ANEXA
Prescriptie Anexa nr. I (ANEXA nr. 2 la Ordinul 1605/875/2014) SECŢIUNEA C2 - LISTA denumirilor comerciale și a preturilor de decontare a medicamentel
 Prescriptie Anexa nr. I (ANEXA nr. 2 la Ordinul 1605/875/2014) SECŢIUNEA C2 - LISTA denumirilor comerciale și a preturilor de decontare a medicamentelor care se acordă bolnavilor cuprinși in cadrul programele
Prescriptie Anexa nr. I (ANEXA nr. 2 la Ordinul 1605/875/2014) SECŢIUNEA C2 - LISTA denumirilor comerciale și a preturilor de decontare a medicamentelor care se acordă bolnavilor cuprinși in cadrul programele
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZ
 ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
Piața farmaceutică, scădere semnificativă după reducerea prețurilor la medicamentele pe bază de prescripție PRESS RELEASE Pagina 1 București, 13 noiem
 Piața farmaceutică, scădere semnificativă după reducerea prețurilor la medicamentele pe bază de prescripție PRESS RELEASE Pagina 1 București, 13 noiembrie 2015 Conform rezultatelor studiului Pharma & Hospital
Piața farmaceutică, scădere semnificativă după reducerea prețurilor la medicamentele pe bază de prescripție PRESS RELEASE Pagina 1 București, 13 noiembrie 2015 Conform rezultatelor studiului Pharma & Hospital
Act LexBrowser
 MINISTERUL SĂNĂTĂŢII ORDIN pentru modificarea şi completarea Ordinului ministrului sănătăţii nr. 426/2009 privind aprobarea Listei şi preţurilor de decontare ale medicamentelor care se acordă bolnavilor
MINISTERUL SĂNĂTĂŢII ORDIN pentru modificarea şi completarea Ordinului ministrului sănătăţii nr. 426/2009 privind aprobarea Listei şi preţurilor de decontare ale medicamentelor care se acordă bolnavilor
RAPORT
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE NIVOLUMABUM INDICAȚIA: MONOTERAPIE PENTRU TRATAMENTUL CANCERULUI SCUAMOS DE CAP SI GAT LA ADULTI LA CARE BOALA PROGRESEAZA IN TIMPUL SAU DUPA TERAPIE DE BAZA
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE NIVOLUMABUM INDICAȚIA: MONOTERAPIE PENTRU TRATAMENTUL CANCERULUI SCUAMOS DE CAP SI GAT LA ADULTI LA CARE BOALA PROGRESEAZA IN TIMPUL SAU DUPA TERAPIE DE BAZA
MINISTERUL SĂNĂTĂȚII DIRECȚIA POLITICA MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Nr / Avizat, SECRETAR DE STAT DAN OCTAVIAN ALEXANDR
 MINISTERUL SĂNĂTĂȚII DIRECȚIA POLITICA MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Nr. 29288/17.05.2019 Avizat, SECRETAR DE STAT DAN OCTAVIAN ALEXANDRESCU Aprob, MINISTRU SORINA PINTEA REFERAT DE APROBARE
MINISTERUL SĂNĂTĂȚII DIRECȚIA POLITICA MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Nr. 29288/17.05.2019 Avizat, SECRETAR DE STAT DAN OCTAVIAN ALEXANDRESCU Aprob, MINISTRU SORINA PINTEA REFERAT DE APROBARE
ANEXA 5 (ANEXA 2a la Ordinul CNAS n SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE IN
 ANEXA 5 (ANEXA 2a la Ordinul CNAS n SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE
ANEXA 5 (ANEXA 2a la Ordinul CNAS n SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE
MINISTERUL SĂNĂTĂȚII AGENȚIA NAȚIONALĂ A MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Departamentul de Evaluare a Tehnologiilor Medicale Str. Aviator S
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: RIOCIGUAT INDICAȚII: HIPERTENSIUNE ARTERIALĂ PULMONARĂ CRONICĂ HIPOEMBOLICĂ (HAPCTE) HIPERTENSIUNE ARTERIALĂ PULMONARĂ (HAP) Data depunerii dosarului 08.04.2015
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: RIOCIGUAT INDICAȚII: HIPERTENSIUNE ARTERIALĂ PULMONARĂ CRONICĂ HIPOEMBOLICĂ (HAPCTE) HIPERTENSIUNE ARTERIALĂ PULMONARĂ (HAP) Data depunerii dosarului 08.04.2015
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE EPLERENONUM INDICAȚIA: INSUFICIENŢA CARDIACĂ Data de depunere dosar 20.08.2014 Numar dosar 3160 PUNCTAJ: 55 1. DATE GENERALE 1.1. DCI: Eplerenonum 1.2.1. DC:
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE EPLERENONUM INDICAȚIA: INSUFICIENŢA CARDIACĂ Data de depunere dosar 20.08.2014 Numar dosar 3160 PUNCTAJ: 55 1. DATE GENERALE 1.1. DCI: Eplerenonum 1.2.1. DC:
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DABRAFENIBUM INDICAȚIA: MELANOM INOPERABIL SAU METASTATIC POZITIV LA MUTATIA BRAF V600 Data de depunere dosar 11.08.2014 Numar dosar 3035 PUNCTAJ: 65 1. DATE
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DABRAFENIBUM INDICAȚIA: MELANOM INOPERABIL SAU METASTATIC POZITIV LA MUTATIA BRAF V600 Data de depunere dosar 11.08.2014 Numar dosar 3035 PUNCTAJ: 65 1. DATE
CU 1 FLAC. DIN STICLA TRANSPARENTA CONTINÂND PULB. PENTRU 100 ML SUSPENSIE SI O LINGURITA DOZATOARE DIN POLISTIREN, MARCAT CU GRADATII PT. MASURAREA V
 CU 1 FLAC. DIN STICLA TRANSPARENTA CONTINÂND PULB. PENTRU 100 ML SUSPENSIE SI O LINGURITA DOZATOARE DIN POLISTIREN, MARCAT CU GRADATII PT. MASURAREA VOLUMELOR 2,5 ML SI 5,0 ML PRF ANEXA 6 (ANEXA 2a la
CU 1 FLAC. DIN STICLA TRANSPARENTA CONTINÂND PULB. PENTRU 100 ML SUSPENSIE SI O LINGURITA DOZATOARE DIN POLISTIREN, MARCAT CU GRADATII PT. MASURAREA VOLUMELOR 2,5 ML SI 5,0 ML PRF ANEXA 6 (ANEXA 2a la
MINISTERUL SĂNĂTĂȚII AGENȚIA NAȚIONALĂ A MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Departamentul de Evaluare a Tehnologiilor Medicale Str. Aviator S
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE BENDAMUSTINUM INDICAȚIA: LIMFOM nonhodkin Data de depunere dosar 18.08.2014 Numar dosar 3143 PUNCTAJ: 65 1 1. DATE GENERALE 1.1. DCI: BENDAMUSTINUM 1.2. DC:
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE BENDAMUSTINUM INDICAȚIA: LIMFOM nonhodkin Data de depunere dosar 18.08.2014 Numar dosar 3143 PUNCTAJ: 65 1 1. DATE GENERALE 1.1. DCI: BENDAMUSTINUM 1.2. DC:
Microsoft PowerPoint - Prezentare suport AGOA_ pptx
 Adunarea Generala Ordinara a Actionarilor 23 Aprilie 2019 Agenda Situatia Rezultatului Global Bugetul de Venituri si Cheltuieli 2019 Plan de Investitii Evolutie numerar si echivalente numerar Pozitia companiei
Adunarea Generala Ordinara a Actionarilor 23 Aprilie 2019 Agenda Situatia Rezultatului Global Bugetul de Venituri si Cheltuieli 2019 Plan de Investitii Evolutie numerar si echivalente numerar Pozitia companiei
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZ
 ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
ANEXA 1 SUBLISTA A - LISTA MEDICAMENTELOR CU NIVEL DE COMPENSARE 90% DIN PRETUL DE REFERINTA CONFORM DENUMIRILOR COMUNE INTERNATIONALE (DCI) CORESPUNZATOARE MEDICAMENTELOR DE CARE BENEFICIAZA ASIGURATII,
Microsoft Word _Perfalgan 100ml_UK PIL_II-44+ UT.doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6274/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Paracetamol Sandoz 10 mg/ml soluţie perfuzabilă Paracetamol Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6274/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Paracetamol Sandoz 10 mg/ml soluţie perfuzabilă Paracetamol Citiţi cu atenţie şi în întregime
Minuta: 31
 Minuta: 28 mai 2019 Tema: proiectul de Ordin privind modificarea Anexei nr. 1 la Ordinul ministrului sănătății nr. 1468/2018 pentru aprobarea preţurilor maximale ale medicamentelor de uz uman, valabile
Minuta: 28 mai 2019 Tema: proiectul de Ordin privind modificarea Anexei nr. 1 la Ordinul ministrului sănătății nr. 1468/2018 pentru aprobarea preţurilor maximale ale medicamentelor de uz uman, valabile
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR /2017/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator VENTOLIN 5 mg/ml soluţie de inhalat prin n
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 10302/2017/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator VENTOLIN 5 mg/ml soluţie de inhalat prin nebulizator Salbutamol Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 10302/2017/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator VENTOLIN 5 mg/ml soluţie de inhalat prin nebulizator Salbutamol Citiţi cu atenţie şi în întregime
ORDIN nr. 846 din 3 iulie 2018 pentru modificarea şi completarea anexelor nr. 2 şi 4 la Ordinul ministrului sănătăţii şi al preşedintelui Casei Naţion
 ORDIN nr. 846 din 3 iulie 2018 pentru modificarea şi completarea anexelor nr. 2 şi 4 la Ordinul ministrului sănătăţii şi al preşedintelui Casei Naţionale de Asigurări de Sănătate nr. 1.605/875/2014 privind
ORDIN nr. 846 din 3 iulie 2018 pentru modificarea şi completarea anexelor nr. 2 şi 4 la Ordinul ministrului sănătăţii şi al preşedintelui Casei Naţionale de Asigurări de Sănătate nr. 1.605/875/2014 privind
Microsoft Word - Lansoprazole_Annex_I-III_ro
 ANEXA I LISTA CU DENUMIRILE COMERCIALE, FORMA FARMACEUTICĂ, CONCENTRAŢIILE MEDICAMENTULUI, CALEA DE ADMINISTRARE, SOLICITANŢII, DEŢINĂTORII AUTORIZAŢIEI DE PUNERE PE PIAŢĂ ÎN STATELE MEMBRE Statul Membru
ANEXA I LISTA CU DENUMIRILE COMERCIALE, FORMA FARMACEUTICĂ, CONCENTRAŢIILE MEDICAMENTULUI, CALEA DE ADMINISTRARE, SOLICITANŢII, DEŢINĂTORII AUTORIZAŢIEI DE PUNERE PE PIAŢĂ ÎN STATELE MEMBRE Statul Membru
Anexa I Lista denumirilor, formelor farmaceutice, concentraţiilor medicamentelor, calea de administrare, deţinătorii autorizaţiei de punere pe piaţă d
 Anexa I Lista denumirilor, formelor farmaceutice, concentraţiilor medicamentelor, calea de administrare, deţinătorii autorizaţiei de punere pe piaţă din statele membre 1 Stat membru EU/EEA Deţinătorul
Anexa I Lista denumirilor, formelor farmaceutice, concentraţiilor medicamentelor, calea de administrare, deţinătorii autorizaţiei de punere pe piaţă din statele membre 1 Stat membru EU/EEA Deţinătorul
Codul EFPIA privind prezentarea de informații Informări 2017 Shire Pharmaceuticals (inclusiv Baxalta US Inc.) 1
 Codul EFPIA privind prezentarea de informații Informări 2017 Shire Pharmaceuticals (inclusiv Baxalta US Inc.) 1 Secțiunea 1: Abordarea privind raportarea datelor din 2017 Pe 3 iunie 2016, Shire a achiziționat
Codul EFPIA privind prezentarea de informații Informări 2017 Shire Pharmaceuticals (inclusiv Baxalta US Inc.) 1 Secțiunea 1: Abordarea privind raportarea datelor din 2017 Pe 3 iunie 2016, Shire a achiziționat
COMUNICAT DE PRESĂ Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale prezintă în cele ce urmează traducerea în limba română a comunicatu
 COMUNICAT DE PRESĂ Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale prezintă în cele ce urmează traducerea în limba română a comunicatului de presă al Agenţiei Europene a Medicamentului
COMUNICAT DE PRESĂ Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale prezintă în cele ce urmează traducerea în limba română a comunicatului de presă al Agenţiei Europene a Medicamentului
ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 368/2017 pentru aprobarea Normelor privind modul de calcul și procedura d
 ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 368/2017 pentru aprobarea Normelor privind modul de calcul și procedura de aprobare a prețurilor maximale ale medicamentelor
ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 368/2017 pentru aprobarea Normelor privind modul de calcul și procedura de aprobare a prețurilor maximale ale medicamentelor
Minuta: 31
 Minuta: 4 iulie 2019 Tema: proiectul de Ordin privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 368/2017 pentru aprobarea Normelor privind modul de calcul și procedura de aprobare
Minuta: 4 iulie 2019 Tema: proiectul de Ordin privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 368/2017 pentru aprobarea Normelor privind modul de calcul și procedura de aprobare
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE MINOCYCLINUM INDICAȚIA: Acnee (determinată de Propionibacterium acnes) Data de depunere dosar 08.09.2014 Numar dosar 3281 PUNCTAJ: 40 1. DATE GENERALE 1.1. DCI:
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE MINOCYCLINUM INDICAȚIA: Acnee (determinată de Propionibacterium acnes) Data de depunere dosar 08.09.2014 Numar dosar 3281 PUNCTAJ: 40 1. DATE GENERALE 1.1. DCI:
Modificări și completări ale anexelor 1 și 2 la Ordinul ministrului sănătății nr. 1468/2018 pentru aprobarea prețurilor maximale ale medicamentelor de
 Modificări și completări ale anexelor 1 și 2 la Ordinul ministrului sănătății nr. 1468/2018 pentru aprobarea prețurilor maximale ale medicamentelor de uz uman, valabile în România, care pot fi utilizate/
Modificări și completări ale anexelor 1 și 2 la Ordinul ministrului sănătății nr. 1468/2018 pentru aprobarea prețurilor maximale ale medicamentelor de uz uman, valabile în România, care pot fi utilizate/
August 2017 COMUNICARE DIRECTĂ CĂTRE PROFESIONIȘTII DIN DOMENIUL SĂNĂTĂȚII Modificarea recomandărilor privind diluarea soluției reconstituite de Dacog
 August 2017 COMUNICARE DIRECTĂ CĂTRE PROFESIONIȘTII DIN DOMENIUL SĂNĂTĂȚII Modificarea recomandărilor privind diluarea soluției reconstituite de Dacogen (decitabină) 50 mg pulbere pentru concentrat pentru
August 2017 COMUNICARE DIRECTĂ CĂTRE PROFESIONIȘTII DIN DOMENIUL SĂNĂTĂȚII Modificarea recomandărilor privind diluarea soluției reconstituite de Dacogen (decitabină) 50 mg pulbere pentru concentrat pentru
PRO_4804_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4804/2012/01-02-03-04 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR CEREBROLYSIN 215,2 mg/ml soluţie injectabilă/concentrat pentru soluţie perfuzabilă Citiţi
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4804/2012/01-02-03-04 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR CEREBROLYSIN 215,2 mg/ml soluţie injectabilă/concentrat pentru soluţie perfuzabilă Citiţi
REGULAMENTUL CAMPANIEI PROMOŢIONALE
 Organizatorul campaniei REGULAMENTUL CAMPANIEI PROMOŢIONALE - 30% reducere la produsele selectionate Campania promoţională - 30% reducere la produsele selectionate" (denumită în cele ce urmează "Campania"
Organizatorul campaniei REGULAMENTUL CAMPANIEI PROMOŢIONALE - 30% reducere la produsele selectionate Campania promoţională - 30% reducere la produsele selectionate" (denumită în cele ce urmează "Campania"
Strategia IT&C a Agenţiei Naţională a Medicamentului şi Dispozitivelor Medicale
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: INSULINUM DEGLUDEC INDICAŢIA: TRATAMENTUL DIABETULUI ZAHARAT LA ADULȚI Data depunerii dosarului 29.05.2019 Număr dosar 23402 PUNCTAJ: 85 1. DATE GENERALE
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: INSULINUM DEGLUDEC INDICAŢIA: TRATAMENTUL DIABETULUI ZAHARAT LA ADULȚI Data depunerii dosarului 29.05.2019 Număr dosar 23402 PUNCTAJ: 85 1. DATE GENERALE
Rezultatele Licitației publice nr. 18/03207 din Achiziționarea medicamentelor necesare instituțiilor medico-sanitare publice (IMSP) pentru
 Rezultatele Licitației publice nr. 18/03207 din 22.10.2018 Achiziționarea medicamentelor necesare instituțiilor medico-sanitare publice (IMSP) pentru anul 2019 (lista suplimentară) Nr. DCI Dozare Forma
Rezultatele Licitației publice nr. 18/03207 din 22.10.2018 Achiziționarea medicamentelor necesare instituțiilor medico-sanitare publice (IMSP) pentru anul 2019 (lista suplimentară) Nr. DCI Dozare Forma
PRO_671_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 671/2008/01 Anexa 1' Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR VIBROCIL ACTILONG MENTOL 1 mg/ml spray nazal cu doze măsurate soluţie Clorhidrat de xilometazolină
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 671/2008/01 Anexa 1' Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR VIBROCIL ACTILONG MENTOL 1 mg/ml spray nazal cu doze măsurate soluţie Clorhidrat de xilometazolină
La Ordinul MS şi CNAM
 Lista elor compensate din fondurile asigurării obligatorii de asistenţă medicală (denumirile comerciale, care corespund DCI-urilor incluse în Ordinul comun al Ministerului Sănătăţii şi CNAM nr.492/139-a
Lista elor compensate din fondurile asigurării obligatorii de asistenţă medicală (denumirile comerciale, care corespund DCI-urilor incluse în Ordinul comun al Ministerului Sănătăţii şi CNAM nr.492/139-a
Microsoft Word - EMEA ENRO
 ANEXA I LISTA CU DENUMIRILE COMERCIALE, FORMA FARMACEUTICĂ, CONCENTRAŢIA (CONCENTRAŢIILE) PRODUSULUI MEDICAMENTOS, CALEA DE ADMINISTRARE, SOLICITANTUL, TITULARUL AUTORIZAŢIEI DE INTRODUCERE PE PIAŢĂ ÎN
ANEXA I LISTA CU DENUMIRILE COMERCIALE, FORMA FARMACEUTICĂ, CONCENTRAŢIA (CONCENTRAŢIILE) PRODUSULUI MEDICAMENTOS, CALEA DE ADMINISTRARE, SOLICITANTUL, TITULARUL AUTORIZAŢIEI DE INTRODUCERE PE PIAŢĂ ÎN
PRO_4657_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4657/2004/01-02-03-04-05 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR LACTECON 667 g/l lichid oral Lactuloză Citiţi cu atenţie şi în întregime acest prospect
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4657/2004/01-02-03-04-05 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR LACTECON 667 g/l lichid oral Lactuloză Citiţi cu atenţie şi în întregime acest prospect
Codul EFPIA privind prezentarea de informații Informări 2018 Shire Pharmaceuticals 1
 Codul EFPIA privind prezentarea de informații Informări 2018 Shire Pharmaceuticals 1 Secțiunea 1: Abordarea privind raportarea datelor din 2018 Pe 3 iunie 2016, Shire a achiziționat Baxalta. În conformitate
Codul EFPIA privind prezentarea de informații Informări 2018 Shire Pharmaceuticals 1 Secțiunea 1: Abordarea privind raportarea datelor din 2018 Pe 3 iunie 2016, Shire a achiziționat Baxalta. În conformitate
PRO_4755_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4755/2012/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Technescan PYP 20 mg kit pentru preparat radiofarmaceutic Pirofosfat de sodiu decahidrat Citiţi cu
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 4755/2012/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Technescan PYP 20 mg kit pentru preparat radiofarmaceutic Pirofosfat de sodiu decahidrat Citiţi cu
Situatie AIP_iulie2019.xls
 Nr. Crt. 337 336 Lista cu Autorizatii de Import Paralel (AIP) Denumire comerciala DCI Forma farmaceutică Concentraţia Ambalaj Codul ATC DAIP EXODERIL 10 mg/g cremă NO-SPA 40 mg Clorhidrat de naftifină
Nr. Crt. 337 336 Lista cu Autorizatii de Import Paralel (AIP) Denumire comerciala DCI Forma farmaceutică Concentraţia Ambalaj Codul ATC DAIP EXODERIL 10 mg/g cremă NO-SPA 40 mg Clorhidrat de naftifină
PRO_837_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 837/2008/01-02 Anexa 1' Prospect Prospect: Informaţii pentru utilizator Diclac 50 mg/g gel Diclofenac sodic Citiţi cu atenţie şi în întregime acest prospect înainte de
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 837/2008/01-02 Anexa 1' Prospect Prospect: Informaţii pentru utilizator Diclac 50 mg/g gel Diclofenac sodic Citiţi cu atenţie şi în întregime acest prospect înainte de
AUTORIZATIE DE PUNERE PE PIAŢĂ NR. 5294/2005/01-02, 5295/2005/01-02 Anexa 1 Prospect Prospect: Informații pentru utilizator Keflex 125 mg/5 ml granule
 AUTORIZATIE DE PUNERE PE PIAŢĂ NR. 5294/2005/01-02, 5295/2005/01-02 Anexa 1 Prospect Prospect: Informații pentru utilizator Keflex 125 mg/5 ml granule pentru suspensie orală Keflex 250 mg/5 ml granule
AUTORIZATIE DE PUNERE PE PIAŢĂ NR. 5294/2005/01-02, 5295/2005/01-02 Anexa 1 Prospect Prospect: Informații pentru utilizator Keflex 125 mg/5 ml granule pentru suspensie orală Keflex 250 mg/5 ml granule
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: BRENTUXIMAB VEDOTIN INDICAŢIA: LIMFOM HODGKIN CD30+ RECIDIVAT SAU REFRACTAR: 1. DUPĂ TRANSPLANT DE CELULE STEM AUTOLOGE (TCSA) 2. DUPĂ CEL PUŢIN DOUĂ TRATAMENTE
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: BRENTUXIMAB VEDOTIN INDICAŢIA: LIMFOM HODGKIN CD30+ RECIDIVAT SAU REFRACTAR: 1. DUPĂ TRANSPLANT DE CELULE STEM AUTOLOGE (TCSA) 2. DUPĂ CEL PUŢIN DOUĂ TRATAMENTE
Anexa 2 la Conditiile Generale de Afaceri Lista de dobanzi, taxe si comisioane pentru persoane fizice In vigoare incepand cu I. Contul cure
 Anexa 2 la Conditiile Generale de Afaceri Lista de dobanzi, taxe si comisioane pentru persoane fizice In vigoare incepand cu 15.07.2019 I. Contul curent standard A. SERVICII DE CONT CURENT CONTURI CURENTE
Anexa 2 la Conditiile Generale de Afaceri Lista de dobanzi, taxe si comisioane pentru persoane fizice In vigoare incepand cu 15.07.2019 I. Contul curent standard A. SERVICII DE CONT CURENT CONTURI CURENTE
Harmonised DHPC letter_BCR-ABLTKIs_HepBreactivation_19Feb2016_PRAC version
 Martie 2016 Comunicare directă către profesioniştii din domeniul sănătăţii Inhibitori de tirozin-kinază BCR-ABL (imatinib, dasatinib, nilotinib, bosutinib, ponatinib) Necesitatea de a efectua o testare
Martie 2016 Comunicare directă către profesioniştii din domeniul sănătăţii Inhibitori de tirozin-kinază BCR-ABL (imatinib, dasatinib, nilotinib, bosutinib, ponatinib) Necesitatea de a efectua o testare
ANEXA II
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7270/2014/01-02-03-04-05-06-07-08-09 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Voltaren Forte 23,2 mg/g gel Diclofenac dietilamină Citiţi cu atenţie şi
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7270/2014/01-02-03-04-05-06-07-08-09 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Voltaren Forte 23,2 mg/g gel Diclofenac dietilamină Citiţi cu atenţie şi
CEL DE AL 4-LEA RAPORT AL COMISIEI EUROPENE PRIVIND STAREA UNIUNII ENERGETICE Conform Comunicatului Comisiei Europene din data de 9 aprilie 2019, Comi
 CEL DE AL 4-LEA RAPORT AL COMISIEI EUROPENE PRIVIND STAREA UNIUNII ENERGETICE Conform Comunicatului Comisiei Europene din data de 9 aprilie 2019, Comisia Europeană și-a îndeplinit pe deplin angajamentele
CEL DE AL 4-LEA RAPORT AL COMISIEI EUROPENE PRIVIND STAREA UNIUNII ENERGETICE Conform Comunicatului Comisiei Europene din data de 9 aprilie 2019, Comisia Europeană și-a îndeplinit pe deplin angajamentele
Cytopoint, INN-lokivetmab
 ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR CYTOPOINT 10 mg soluție injectabilă pentru câini CYTOPOINT 20 mg soluție injectabilă pentru câini CYTOPOINT
ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR CYTOPOINT 10 mg soluție injectabilă pentru câini CYTOPOINT 20 mg soluție injectabilă pentru câini CYTOPOINT
Enurace Annexes I-II-III
 ANEXA I NUME, FORMA FARMACEUTICĂ, DOZAJUL PRODUSULUI MEDICAMENTOS, SPECII ANIMALE, CĂI DE ADMINISTRARE ŞI DEŢINĂTORUL AUTORIZAŢIEI DE COMERCIALIZARE 1/7 State membre Solicitant sau deţinătorul autorizaţiei
ANEXA I NUME, FORMA FARMACEUTICĂ, DOZAJUL PRODUSULUI MEDICAMENTOS, SPECII ANIMALE, CĂI DE ADMINISTRARE ŞI DEŢINĂTORUL AUTORIZAŢIEI DE COMERCIALIZARE 1/7 State membre Solicitant sau deţinătorul autorizaţiei
MINISTERUL SĂNĂTĂȚII AGENȚIA NAȚIONALĂ A MEDICAMENTULUI ȘI A DISPOZITIVELOR MEDICALE Departamentul de Evaluare a Tehnologiilor Medicale Str. Aviator S
 RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI VEMURAFENIBUM INDICAȚIA: MELONOM MALIGN Data de depunere dosar 04.08.2014 Numar dosar 2906 PUNCTAJ: 70 1. DATE GENERALE 1.1. DCI: vemurafenib 1.2. DC: Zelboraf
RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI VEMURAFENIBUM INDICAȚIA: MELONOM MALIGN Data de depunere dosar 04.08.2014 Numar dosar 2906 PUNCTAJ: 70 1. DATE GENERALE 1.1. DCI: vemurafenib 1.2. DC: Zelboraf
Versican Plus L4, INN-Inactivated leptospira interrogans serovar bratislava,strain mslb1088/inactivated leptospira interrogans serovar canicola,strain
 ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR Versican Plus L4, suspensie injectabilă, pentru câini 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ Fiecare doză de
ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR Versican Plus L4, suspensie injectabilă, pentru câini 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ Fiecare doză de
Проспект: Информация для пациента, потребителя
 Prospect: Informaţii pentru consumator/pacient Duphalac 667 mg/ml, soluţie orală Lactuloză Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament, deoarece conţine
Prospect: Informaţii pentru consumator/pacient Duphalac 667 mg/ml, soluţie orală Lactuloză Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament, deoarece conţine
PRO_8548_ doc
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 8548/2016/01-18 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Folinat de calciu Kabi 10 mg/ml soluţie injectabilă/perfuzabilă Acid folinic Citiţi cu atenție
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 8548/2016/01-18 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Folinat de calciu Kabi 10 mg/ml soluţie injectabilă/perfuzabilă Acid folinic Citiţi cu atenție
EMA ENRO
 Anexa I Lista cu denumirile comerciale, forma farmaceutică, concentraţia medicamentelor de uz veterinar, speciile de animale, calea de administrare, deţinătorul autorizaţiilor de punere pe piaţă din statele
Anexa I Lista cu denumirile comerciale, forma farmaceutică, concentraţia medicamentelor de uz veterinar, speciile de animale, calea de administrare, deţinătorul autorizaţiilor de punere pe piaţă din statele
AUTORIZATIE DE PUNERE PE PIATA NR
 AUTORIZATIE DE PUNERE PE PIATA NR. 7550/2006/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR VIROLEX 250 mg pulbere pentru soluţie injectabilă/perfuzabilă Aciclovir Citiţi cu atenţie şi în întregime
AUTORIZATIE DE PUNERE PE PIATA NR. 7550/2006/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR VIROLEX 250 mg pulbere pentru soluţie injectabilă/perfuzabilă Aciclovir Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9213/2016/ Anexa 1 Prospect Prospect: Informaţii pentru utilizator Dutasteridă Zentiva 0,5 mg capsule
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9213/2016/01-02-03-04-05 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Dutasteridă Zentiva 0,5 mg capsule moi Dutasteridă Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9213/2016/01-02-03-04-05 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Dutasteridă Zentiva 0,5 mg capsule moi Dutasteridă Citiţi cu atenţie şi în întregime
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9184/2016/01 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Ketof 1 mg/5 ml sirop Ketotifen Citiţi cu aten
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9184/2016/01 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Ketof 1 mg/5 ml sirop Ketotifen Citiţi cu atenţie şi în întregime acest prospect înainte de a începe
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 9184/2016/01 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Ketof 1 mg/5 ml sirop Ketotifen Citiţi cu atenţie şi în întregime acest prospect înainte de a începe
Minuta: 31
 Minuta: 16 mai 2019 Tema: proiectul de Ordin privind modificarea anexei nr. 1 la Ordinul ministrului sănătății publice și al președintelui Casei Naționale de Asigurări de Sănătate nr. 1.301/500/2008 pentru
Minuta: 16 mai 2019 Tema: proiectul de Ordin privind modificarea anexei nr. 1 la Ordinul ministrului sănătății publice și al președintelui Casei Naționale de Asigurări de Sănătate nr. 1.301/500/2008 pentru
Săptămâna Europeană a Vaccinării # Vaccinurile sunt benefice Prevenire Să ne protejăm împreună Protecție Vaccinare aprilie 2019 Între 1 ianuarie
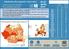 Săptămâna Europeană a Vaccinării 20-25 aprilie 2019 Între 1 ianuarie 2018 și 31 decembrie 2018, 30 de State Membre UE/SEE au raportat 12352 cazuri de rujeolă, din care 8596 (70%) au fost confirmate cu
Săptămâna Europeană a Vaccinării 20-25 aprilie 2019 Între 1 ianuarie 2018 și 31 decembrie 2018, 30 de State Membre UE/SEE au raportat 12352 cazuri de rujeolă, din care 8596 (70%) au fost confirmate cu
Microsoft Word - societatea informationala.doc
 I Principalii indicatori ai societăţii informaţionale la nivel naţional Indicator 2013 2014 Număr de linii telefonice fixe la 1000 de locuitori 218,4 212,6 Număr de abonaţi la telefonie mobilă la 1000
I Principalii indicatori ai societăţii informaţionale la nivel naţional Indicator 2013 2014 Număr de linii telefonice fixe la 1000 de locuitori 218,4 212,6 Număr de abonaţi la telefonie mobilă la 1000
Microsoft Word - Pagina garda PS15.doc
 UNIVERSITATEA VASILE ALECSANDRI DIN BACĂ U PRODUSE POTENŢIAL NESIGURE COD: RECTOR, PROF. UNIV. DR. ING. VALENTIN NEDEFF Prenumele şi numele Semnătura Reprezentantul Managementului Elaborat Prof. univ.
UNIVERSITATEA VASILE ALECSANDRI DIN BACĂ U PRODUSE POTENŢIAL NESIGURE COD: RECTOR, PROF. UNIV. DR. ING. VALENTIN NEDEFF Prenumele şi numele Semnătura Reprezentantul Managementului Elaborat Prof. univ.
ETICHETAREA ENERGIEI ELECTRICE FURNIZATE CONSUMATORILOR
 DATE STATISTICE AFERENTE ENERGIEI ELECTRICE PRODUSE ÎN ANUL 2005 Pe baza declaraţiilor transmise de producătorii de energie electrică în luna ianuarie 2006, ANRE a elaborat o situaţie centralizată la nivelul
DATE STATISTICE AFERENTE ENERGIEI ELECTRICE PRODUSE ÎN ANUL 2005 Pe baza declaraţiilor transmise de producătorii de energie electrică în luna ianuarie 2006, ANRE a elaborat o situaţie centralizată la nivelul
ÎMPREUNĂ PENTRU PACIENTUL CU SCA ÎN PRIMUL AN POST EVENIMENTUL ACUT Medicamentul BRILIQUE 90mg, DCI Ticagrelor, este 100% compensat pentru pacienții c
 ÎMPREUNĂ PENTRU PACIENTUL CU SCA ÎN PRIMUL AN POST EVENIMENTUL ACUT Medicamentul BRILIQUE 90mg, DCI Ticagrelor, este 100% compensat pentru pacienții cu SCA tratați invaziv cu stent, în baza unui contract
ÎMPREUNĂ PENTRU PACIENTUL CU SCA ÎN PRIMUL AN POST EVENIMENTUL ACUT Medicamentul BRILIQUE 90mg, DCI Ticagrelor, este 100% compensat pentru pacienții cu SCA tratați invaziv cu stent, în baza unui contract
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6652/2006/ Anexa 1 Prospect Prospect: Informaţii pentru utilizator LERIDIP 20 mg co
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6652/2006/01-02-03-04-05-06-07-08-09-10-11 Anexa 1 Prospect Prospect: Informaţii pentru utilizator LERIDIP 20 mg comprimate filmate Clorhidrat de lercanidipină Citiţi
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6652/2006/01-02-03-04-05-06-07-08-09-10-11 Anexa 1 Prospect Prospect: Informaţii pentru utilizator LERIDIP 20 mg comprimate filmate Clorhidrat de lercanidipină Citiţi
Microsoft Word - 1_RAPORTUL ADMINISTRATORILOR PENTRU SEMESTRUL I 2010 nesemnat.doc
 RAPORTUL ADMINISTRATORILOR PENTRU SEMESTRUL I 2010 Raport anual conform: OMF 3055/2009 Pentru exercitiul financiar : 30.06.2010 Data raportului: 12 august 2010 Denumirea societatii comerciale: Antibiotice
RAPORTUL ADMINISTRATORILOR PENTRU SEMESTRUL I 2010 Raport anual conform: OMF 3055/2009 Pentru exercitiul financiar : 30.06.2010 Data raportului: 12 august 2010 Denumirea societatii comerciale: Antibiotice
Furosemide Vitabalans Annex I_II_ro
 Anexa I Lista numelor, formelor farmaceutice, concentraţiilor medicamentului, calea de administrare, aplicantul în Statele Membre 1 Statele Membre UE/AEE Solicitantul Denumire comercială Concentraţia Forma
Anexa I Lista numelor, formelor farmaceutice, concentraţiilor medicamentului, calea de administrare, aplicantul în Statele Membre 1 Statele Membre UE/AEE Solicitantul Denumire comercială Concentraţia Forma
RESPIPORC FLUpan H1N1, INN: porcine influenza vaccine (inactivated)
 ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR RESPIPORC FLUpan H1N1, suspensie injectabilă, pentru porci 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ Fiecare doză
ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR RESPIPORC FLUpan H1N1, suspensie injectabilă, pentru porci 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ Fiecare doză
COMUNICAT DE PRESĂ
 COMUNICAT DE PRESĂ Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale prezintă în cele ce urmează traducerea în limba română a comunicatului de presă al Agenţiei Europene a Medicamentului
COMUNICAT DE PRESĂ Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale prezintă în cele ce urmează traducerea în limba română a comunicatului de presă al Agenţiei Europene a Medicamentului
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7695/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator PREGNYL 5000 UI/ml pulbere şi solvent pentr
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7695/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator PREGNYL 5000 UI/ml pulbere şi solvent pentru soluţie injectabilă Gonadotrofină corionică umană
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7695/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator PREGNYL 5000 UI/ml pulbere şi solvent pentru soluţie injectabilă Gonadotrofină corionică umană
Microsoft Word - anunt prealabil selectie 2018.doc
 INFORMAŢII PRIVIND CONCURSURILE DE SELECŢIE PENTRU MOBILITÃŢI ERASMUS+ (KA103) IN TARILE PROGRAMULUI ERASMUS+ In perioada urmãtoare va trebui sa fiti foarte atenti la continututul anunturilor privind sesiunile
INFORMAŢII PRIVIND CONCURSURILE DE SELECŢIE PENTRU MOBILITÃŢI ERASMUS+ (KA103) IN TARILE PROGRAMULUI ERASMUS+ In perioada urmãtoare va trebui sa fiti foarte atenti la continututul anunturilor privind sesiunile
Consiliul Uniunii Europene Bruxelles, 8 noiembrie 2016 (OR. en) 13583/16 BUDGET 29 EXPUNERE DE MOTIVE Subiect: Proiect de buget rectificativ nr. 4 la
 Consiliul Uniunii Europene Bruxelles, 8 noiembrie 2016 (OR. en) 13583/16 BUDGET 29 EXPUNERE DE MOTIVE Subiect: Proiect de buget rectificativ nr. 4 la bugetul general pentru exercițiul financiar 2016: Actualizarea
Consiliul Uniunii Europene Bruxelles, 8 noiembrie 2016 (OR. en) 13583/16 BUDGET 29 EXPUNERE DE MOTIVE Subiect: Proiect de buget rectificativ nr. 4 la bugetul general pentru exercițiul financiar 2016: Actualizarea
MINISTERUL SĂNĂTĂŢII ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 861/2014 pentru aprobarea criteriilor şi metodologie
 MINISTERUL SĂNĂTĂŢII ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 861/2014 pentru aprobarea criteriilor şi metodologiei de evaluare a tehnologiilor medicale, a documentaţiei
MINISTERUL SĂNĂTĂŢII ORDIN privind modificarea şi completarea Ordinului ministrului sănătăţii nr. 861/2014 pentru aprobarea criteriilor şi metodologiei de evaluare a tehnologiilor medicale, a documentaţiei
PowerPoint-Präsentation
 Creditarea companiilor evoluţii şi provocări Cristian Sporis, Vicepreşedinte Raiffeisen Bank Iulie 19 1 Reducere amplă a intermedierii financiare bancare în ţările membre UE 3 4 18 Soldul creditelor acordate
Creditarea companiilor evoluţii şi provocări Cristian Sporis, Vicepreşedinte Raiffeisen Bank Iulie 19 1 Reducere amplă a intermedierii financiare bancare în ţările membre UE 3 4 18 Soldul creditelor acordate
simva leaflet
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 2786/2010/01-02-03-04-05-06 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Escepran 25 mg comprimate filmate Exemestan Citiţi cu atenţie şi în întregime acest
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 2786/2010/01-02-03-04-05-06 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Escepran 25 mg comprimate filmate Exemestan Citiţi cu atenţie şi în întregime acest
VISINE®
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6026/2013/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Osetron 4 mg comprimate filmate Ondansetron Citiţi cu atenţie şi în întregime acest prospect înainte
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6026/2013/01 Anexa 1 Prospect PROSPECT: INFORMAŢII PENTRU UTILIZATOR Osetron 4 mg comprimate filmate Ondansetron Citiţi cu atenţie şi în întregime acest prospect înainte
AUTORIZATIE DE PUNERE PE PIATĂ NR
 AUTORIZATIE DE PUNERE PE PIATA NR. 5996/2005/01; 5997/2005/01; 5998/2005/01 Anexa 1 5999/2005/01; 6000/2005/01 Prospect EPOKINE 1000 UI/0,5 ml Solutie injectabila, 1000 UI/0,5 ml EPOKINE 2000 UI/0,5 ml
AUTORIZATIE DE PUNERE PE PIATA NR. 5996/2005/01; 5997/2005/01; 5998/2005/01 Anexa 1 5999/2005/01; 6000/2005/01 Prospect EPOKINE 1000 UI/0,5 ml Solutie injectabila, 1000 UI/0,5 ml EPOKINE 2000 UI/0,5 ml
SPC in English
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 3864/2011/01-20 Anexa 2 Rezumatul caracteristicilor produsului REZUMATUL CARACTERISTICILOR PRODUSULUI 1.DENUMIREA COMERCIALĂ A MEDICAMENTULUI Molaxole pulbere pentru
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 3864/2011/01-20 Anexa 2 Rezumatul caracteristicilor produsului REZUMATUL CARACTERISTICILOR PRODUSULUI 1.DENUMIREA COMERCIALĂ A MEDICAMENTULUI Molaxole pulbere pentru
FACULTATEA DE FARMACIE EXAMENUL DE LICENŢĂ PROGRAMUL DE STUDII FARMACIE SESIUNEA SEPTEMBRIE 2019 Examenul de licenţă la Facultatea de Farmacie -progra
 EXAMENUL DE LICENŢĂ PROGRAMUL DE STUDII FARMACIE SESIUNEA SEPTEMBRIE 2019 Examenul de licenţă la Facultatea de Farmacie -programul de studii FARMACIE se desfăşoară conform regulamentului de licenţă în
EXAMENUL DE LICENŢĂ PROGRAMUL DE STUDII FARMACIE SESIUNEA SEPTEMBRIE 2019 Examenul de licenţă la Facultatea de Farmacie -programul de studii FARMACIE se desfăşoară conform regulamentului de licenţă în
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7218/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Lutinus 100 mg comprimate vaginale Progeste
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7218/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Lutinus 100 mg comprimate vaginale Progesteron Citiţi cu atenţie şi în întregime acest prospect
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7218/2014/01-02 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Lutinus 100 mg comprimate vaginale Progesteron Citiţi cu atenţie şi în întregime acest prospect
Marixino, INN - Memantine hydrochloride
 Prospect: Informaţii pentru utilizator Marixino 10 mg comprimate filmate Clorhidrat de memantină Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament deoarece
Prospect: Informaţii pentru utilizator Marixino 10 mg comprimate filmate Clorhidrat de memantină Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament deoarece
Stimate pacient, Pe această cale vă aducem la cunoştinţă faptul că s-a semnat contractul cost-volum-rezultat pentru tratamentul cu Harvoni (SOFOSBUVIR
 Stimate pacient, Pe această cale vă aducem la cunoştinţă faptul că s-a semnat contractul cost-volum-rezultat pentru tratamentul cu Harvoni (SOFOSBUVIR+LEDIPASVIR) al cirozei hepatice cu virus C, forma
Stimate pacient, Pe această cale vă aducem la cunoştinţă faptul că s-a semnat contractul cost-volum-rezultat pentru tratamentul cu Harvoni (SOFOSBUVIR+LEDIPASVIR) al cirozei hepatice cu virus C, forma
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7264/2014/ Anexa 1 Prospect Prospect: informaţii pentru utilizator Betaserc 24 mg comprimate orodispe
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7264/2014/01-02-03-04-05 Anexa 1 Prospect Prospect: informaţii pentru utilizator Betaserc 24 mg comprimate orodispersabile Diclorhidrat de betahistină Citiţi cu atenţie
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 7264/2014/01-02-03-04-05 Anexa 1 Prospect Prospect: informaţii pentru utilizator Betaserc 24 mg comprimate orodispersabile Diclorhidrat de betahistină Citiţi cu atenţie
Prospect: Informaţii pentru utilizator Imodium 2mg, capsule Clorhidrat de loperamidă Citiţi cu atenţie şi în întregime acest prospect înainte de a înc
 Prospect: Informaţii pentru utilizator Imodium 2mg, capsule Clorhidrat de loperamidă Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament, deoarece conţine
Prospect: Informaţii pentru utilizator Imodium 2mg, capsule Clorhidrat de loperamidă Citiţi cu atenţie şi în întregime acest prospect înainte de a începe să utilizaţi acest medicament, deoarece conţine
PowerPoint Presentation
 PROVOCARILE GESTIONARII DESEURILOR PE PIATA DIN ROMANIA IN CONTEXT EUROPEAN Bucuresti, 3 Iulie 2018 1 Economia circulara RESURSE NATURALE EXPLOATARE UTILIZARE ELIMINARE Sursa: EC 2 Tintele prevazute in
PROVOCARILE GESTIONARII DESEURILOR PE PIATA DIN ROMANIA IN CONTEXT EUROPEAN Bucuresti, 3 Iulie 2018 1 Economia circulara RESURSE NATURALE EXPLOATARE UTILIZARE ELIMINARE Sursa: EC 2 Tintele prevazute in
PowerPoint Presentation
 Parametrii de calitate ai apelor minerale naturale din Romania Ileana Radulescu, Marian Romeo Calin, Alina Catrinel Ion Laborator SALMROM, Departamentul de Fizica Vietii si Mediului, Institutul National
Parametrii de calitate ai apelor minerale naturale din Romania Ileana Radulescu, Marian Romeo Calin, Alina Catrinel Ion Laborator SALMROM, Departamentul de Fizica Vietii si Mediului, Institutul National
Raportare TRIMESTRUL III 2007.xls
 CASA DE ASIGURARI DE SANATATE Subprogram 3. TRATAMENTUL BOLNAVILOR CU AFECTIUNI CARDIOVASCULARE PRIN CHIRURGIE CARDIOVASCULARA SI PRIN CARDIOLOGIE INTERVENTIONALA SI ELECTROFIZIOLOGIE Tabel 3.1 SITUATIA
CASA DE ASIGURARI DE SANATATE Subprogram 3. TRATAMENTUL BOLNAVILOR CU AFECTIUNI CARDIOVASCULARE PRIN CHIRURGIE CARDIOVASCULARA SI PRIN CARDIOLOGIE INTERVENTIONALA SI ELECTROFIZIOLOGIE Tabel 3.1 SITUATIA
Cuprins Abrevieri XIII Cuvânt-înainte XV Capitolul I. Sistemul achiziţiilor publice: concepte definitorii, evoluţie, instituţii implicate, căi de atac
 Abrevieri XIII Cuvânt-înainte XV Capitolul I. Sistemul achiziţiilor publice: concepte definitorii, evoluţie, instituţii implicate, căi de atac 1 1. Aspecte preliminare 1 2. Sediul normativ al materiei
Abrevieri XIII Cuvânt-înainte XV Capitolul I. Sistemul achiziţiilor publice: concepte definitorii, evoluţie, instituţii implicate, căi de atac 1 1. Aspecte preliminare 1 2. Sediul normativ al materiei
Council of the European Union Brussels, 9 September 2019 Interinstitutional File: 2005/0227 (COD) 10633/19 JUR 372 MI 538 ECO 72 SAN 317 CODEC 1263 LE
 Council of the European Union Brussels, 9 September 2019 Interinstitutional File: 2005/0227 (COD) 10633/19 JUR 372 MI 538 ECO 72 SAN 317 CODEC 1263 LEGISLATIVE ACTS AND OTHER INSTRUMENTS: CORRIGENDUM/RECTIFICATIF
Council of the European Union Brussels, 9 September 2019 Interinstitutional File: 2005/0227 (COD) 10633/19 JUR 372 MI 538 ECO 72 SAN 317 CODEC 1263 LEGISLATIVE ACTS AND OTHER INSTRUMENTS: CORRIGENDUM/RECTIFICATIF
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6475/2014/ Anexa 1 Prospect Prospect: Informaţii pentru utilizator Aminoplasmal 100 g/l cu electroliţi solu
 AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6475/2014/01-02-03 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Aminoplasmal 100 g/l cu electroliţi soluţie perfuzabilă Aminoacizi şi electroliţi Citiţi cu
AUTORIZAŢIE DE PUNERE PE PIAŢĂ NR. 6475/2014/01-02-03 Anexa 1 Prospect Prospect: Informaţii pentru utilizator Aminoplasmal 100 g/l cu electroliţi soluţie perfuzabilă Aminoacizi şi electroliţi Citiţi cu
Fevaxyn Pentofel
 ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR Fevaxyn Pentofel, suspensie injectabilă pentru pisici 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ O doză de 1 ml
ANEXA I REZUMATUL CARACTERISTICILOR PRODUSULUI 1 1. DENUMIREA PRODUSULUI MEDICINAL VETERINAR Fevaxyn Pentofel, suspensie injectabilă pentru pisici 2. COMPOZIŢIA CALITATIVĂ ŞI CANTITATIVĂ O doză de 1 ml
